Zwalczanie nadużyć zaawansowanego przemysłu farmaceutycznego zaczęło być traktowane jako jeden z priorytetów w zakresie egzekwowania prawa konkurencji pod koniec pierwszej dekady XX wieku. Trend ten rozpoczął się w Stanach Zjednoczonych, a na grunt europejski przeniesiony został przez Komisję Europejską. Jej aktywność stymuluje działania organów antymonopolowych wielu Państw Członkowskich, a niekiedy skłania również poszkodowanych do występowania z roszczeniami odszkodowawczymi przeciwko producentom nadmiernie drogich leków.
1. Społeczno-gospodarcze tło sporu
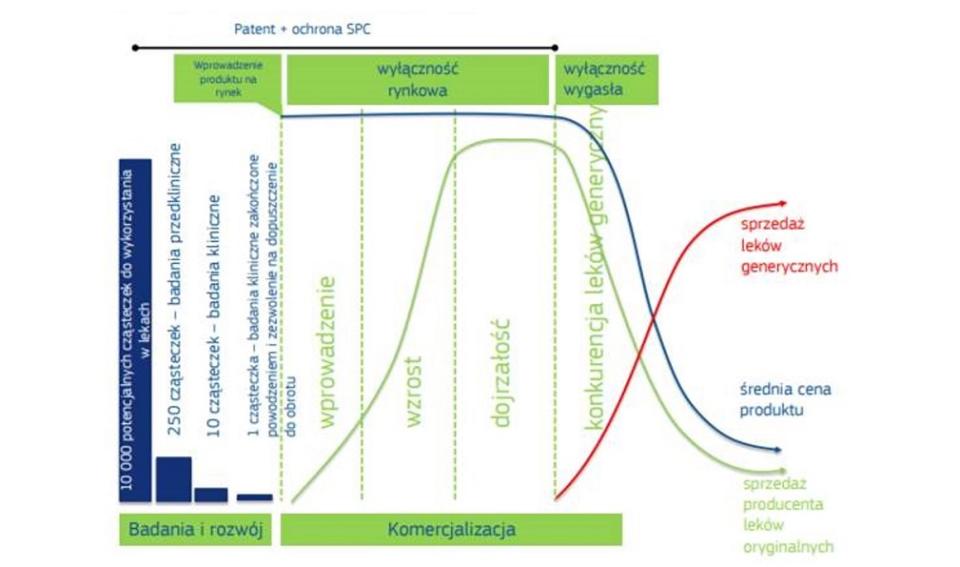
Prace nad nowymi lekami wymagają ogromnych nakładów, wiążą się z poważnym ryzykiem i wymagają długiego okresu oczekiwania na zwrot z inwestycji. Nie dziwi zatem fakt, że nowoczesne farmaceutyki są bardzo drogie, a pogląd, że sztuczne obniżenie ich cen stwarzać może niebezpieczeństwo podważenia całego systemu finansowania badań nad nowymi farmaceutykami, nie jest pozbawiony racjonalności.
Z drugiej jednak strony, nadmiernym i deformującym uproszczeniem jest twierdzenie, iż im droższe leki i silniejsza ochrona praw do nich, tym szybszy postęp w farmacji. Po przekroczeniu pewnego poziomu cen i ochrony wskazanych praw, zwiększanie dochodów producentów innowacyjnych leków nie znajduje uzasadnienia w postępie nauki. Precyzyjne wskazanie tego optimum jest wyjątkowo trudne i stanowić może przedmiot uprawnionych sporów. Z praktycznego punktu widzenia trzeba jednak przyjąć założenie, iż wyznacza je całokształt systemu prawnego i polityki publicznej. W europejskiej i amerykańskiej przestrzeni prawnej ma miejsce zażarta walka o ustalenie jego położenia. Temperaturę konfliktu podnosi fakt, iż już kilkanaście lat temu w Europie odnotowano spadek ilości innowacyjnych leków wprowadzanych na rynek, co stanowi zagrożenie dla pozycji rynkowej zawansowanych przedsiębiorstw farmaceutycznych. Zjawisku temu towarzyszy wydłużanie okresu pomiędzy wygaśnięciem praw wyłącznych do farmaceutyków a skutecznym wprowadzeniem do obrotu ich generycznych odpowiedników i spadkiem poziomu cen. Połączenie tych dwóch tendencji jest szczególnie niekorzystne ze społecznego punktu widzenia.
Zależności między nakładami na prace na nowymi lekami, poziomem ochrony praw do nich i ich cenami przejrzyście ilustruje następujące grafika przedstawiona przez Komisję Europejską w sprawozdaniu z 28.1.2019 dla Rady i Parlamentu Europejskiego: